Massenproduktion von Lentivirus-Vektoren durch transiente Transfektion
Von Matthew Weston
Was sind lentivirale Vektoren
Lentivirale Vektoren (LVs) werden für den Gentransfer in der Zell- und Gentherapie eingesetzt.[1] Sie haben sich als sicher und wirksam für den Einsatz in klinischen Behandlungen erwiesen und wurden bis 2022 in mehr als 100 laufenden klinischen Studien weltweit für die Ex-vivo-Modifikation von Zellen oder die In-vivo-Therapie eingesetzt. [2] Aufgrund dieser Beliebtheit und der jüngsten Zulassung bestimmter CAR-T-Therapien wird der Markt für die LV-Produktion bis 2026 voraussichtlich auf 800 Millionen Dollar anwachsen.[3] Zu den wichtigsten Behandlungsbereichen gehören Erbkrankheiten wie ß-Thalassämie[4] oder die Parkinson-Krankheit.[5]
"Infolge dieser Beliebtheit klinischer Studien und der kürzlichen Zulassung bestimmter CAR-T-Therapien wird der Markt für die LV-Produktion bis 2026 voraussichtlich auf 800 Millionen Dollar anwachsen."
Der Bedarf an Scale-Up
In dem Maße, wie die Verwendung von LVs in neuen Therapien zunimmt, steigt auch der Bedarf an Technologien, mit denen sich ihre Herstellung steigern lässt. Die Massenproduktion von LVs wird derzeit im Allgemeinen durch die direkte Vergrößerung von Produktionsmethoden im kleinen Maßstab erreicht, beispielsweise durch die Vergrößerung der Kultivierungsfläche durch zusätzliche Kultivierungs-/Produktionseinheiten (oder "Scale-out"). XIAOFAN UND RUI haben die LV-Produktion unter Verwendung des Corning™ HYPERStack™ Zellkulturgefäßes[1] untersucht, das mit Cornings patentrechtlich geschützter High Yield PERformance (HYPER) Technologie ausgestattet ist. In ihrem Bericht werden drei Corning™-Gefäße zum Vergleich herangezogen: eine T-25 CellBIND™-Oberflächenflasche, eine 2-Schicht CellBIND™ CellSTACK™-Kulturkammer und ein HYPERStack™ 12-Schicht-Zellkulturgefäß.
"Die großtechnische Produktion von LVs wird derzeit in der Regel durch die direkte Vergrößerung von kleintechnischen Produktionsverfahren erreicht, z.B. durch die Vergrößerung der Anbaufläche durch zusätzliche Anbau-/Produktionseinheiten (oder 'scaling-out')."
Vergleich von Zellkulturgefäßen
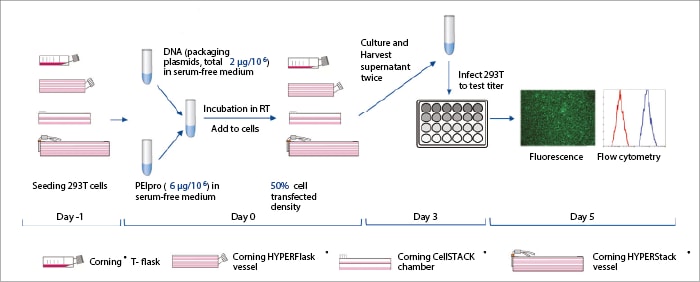
293T-Zellen (ATCC CRL-3216) wurden in Dulbecco's Modified Eagle's Medium (DMEM) mit fötalem Rinderserum (FBS) und einem Antibiotikum/Antimykotikum kultiviert, in die Vergleichskolben ausgesät und vor der Transfektion über Nacht gezüchtet. Es wurde ein Drei-Plasmid-DNA-System hergestellt, und die Transfektionsbedingungen wurden mit Hilfe mathematischer Methoden optimiert.[6] Die Transfektionskomplex-Mischung wurde hergestellt und kurz stehen gelassen, bevor frisches Medium hinzugefügt wurde. Das alte Medium in den Vergleichsgefäßen wurde verworfen, die Transfektionsmischung hinzugefügt und die Gefäße unter kontrollierten Bedingungen bebrütet. Die Überstände wurden geerntet und frisches Medium nach 48 und 72 Stunden zugegeben, und die Extrakte wurden kombiniert. Wachsende 293T-Zellpopulationen wurden auf 12-Well-Platten ausgesät, bebrütet und der LV-haltige Überstand wurde zugegeben. Nach weiterer Inkubation wurden die LV-Titer durch fluoreszenzaktivierte Zellsortierung quantifiziert (Abbildung 1).
Nach Produktion und Titration erreichte das HYPERStack™ 12-Schicht-Gefäß Ausbeuten von 2,9 x 107 TU/mL und 1,2 x 107 TU/cm2, wobei der Gesamttiter 7,5 x 1010 TU erreichte. Die Einheitsvolumina und Flächenerträge der 2-schichtigen CellSTACK™- und T-25-Kolben waren geringer (Abbildung 2).
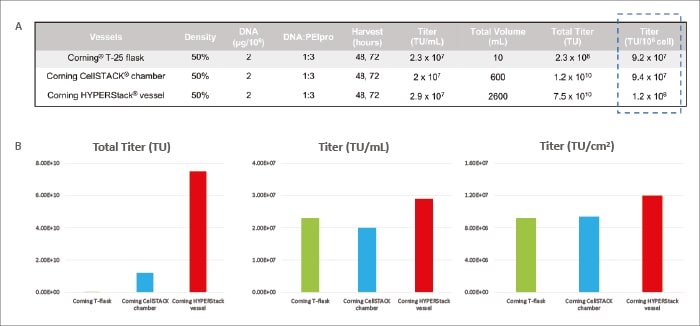
"Das Corning™ HYPERStack™ Gefäß wurde mit herkömmlichen Kulturgefäßen verglichen und es zeigte sich, dass das HYPERStack™ Gefäß einen überlegenen LV-Titer erzeugen kann."
Vorteile von Corning™ HYPERStack™
Das Corning™ HYPERStack™ Zellkulturgefäß vereint das Beste aus zwei Produkten - dem Corning™ CellSTACK™ und dem HYPERFlask™ Zellkulturgefäß.[7] Die HYPER-Technologie zeichnet sich durch eine einzigartige, ultradünne, gasdurchlässige Folie aus, die den Luftspalt im Gefäß eliminiert. Dies führt zu einer beträchtlichen Vergrößerung der Zellwachstumsfläche im Vergleich zu herkömmlichen Stacked-Layer-Gefäßen mit vergleichbarer Grundfläche. Die Verwendung der HYPER-Technologie in der räumlichen Grundfläche des CellSTACK™ liefert ein effizientes, skalierbares Zellkulturgefäß für die adhärente Zellkultur.
Von der Herstellung viraler Vektorimpfstoffe bis hin zur Stammzelltherapie bieten Corning™ HYPERStack™ Gefäße viele Vorteile, darunter:
- Höhere Gesamtzellausbeute - bis zu 5x mehr Wachstumsfläche als ein herkömmliches Zellkulturgefäß mit vergleichbarer Grundfläche
- Ähnliche Zellmorphologie, Phänotyp und Wachstum im Vergleich zu herkömmlichen Gefäßen
- Geschlossenes Systemdesign, ideal für Zellen im großen Maßstab, Proteintherapeutika, Stammzelltherapie, extrazelluläre Vesikel, Impfstoffe und Virusproduktion, einschließlich solcher, die auf COVID-19 abzielen
- Skalierbares Produkt mit mehreren Größenangeboten zur Unterstützung von Scale-up und Scale-out
- Innovative Montage und ergonomisches Design
- Weniger volumetrischer Abfall - bietet ein festes Medienvolumen von 0,2 mL/cm2 Füllungen
Matthew Weston ist ein Content Specialist bei Fisher Scientific UK.
Referenzen
[1] Xiaofan T, Rui C. Large Scale Transient Transfection for the Production of Lentiviral Vectors using the Corning™ HYPERStack™ Cell Culture Vessel: Application Note. Corning Inc. 2022. https://www.corning.com/catalog/cls/documents/application-notes/CLS-AN-669.pdf.
[2] Milone MC, O'Doherty U. Clinical Use of Lentiviral Vectors. Leukemia 2018; 32: 1529-1541. Doi: 10.1038/s41375-018-0106-0.
[3] Southey F. Oxford BioMedica to Capture 25-30% of Lentiviral Vector Market by 2026, Predicts CTO. Dec 10, 2018. Abgerufen von www.biopharma-reporter.com/Article/2018/12/10/Oxford-BioMedicato-capture-25-30-of-lentiviral-vector-market-by-2026-predicts-CTO.
[4] Cavazzana-Calvo M, et al. Transfusionsunabhängigkeit und HMGA2-Aktivierung nach Gentherapie der menschlichen ß-Thalassämie. Nature 2010; 467: 318-322. Doi: 10.1038/nature09328.
[5] Palfi S, et al. Long-Term Safety and Tolerability of ProSavin, a Lentiviral Vector-Based Gene Therapy for Parkinson's Disease: A Dose Escalation, Open-Label, Phase 1/2 Trial. Lancet 2014; 383: 1138-1146. Doi: 10.1016/S0140-6736(13)61939-X.
[6] Yuan W, Chen J, et al. Comparative Analysis and Optimization of Protocols for Producing Recombinant Lentivirus Carrying the anti-Her2 Chimeric Antigen Receptor Gene. J Gene Med 2018; 20(7-8): e3027. doi: 10.1002/jgm.3027.
[7] Corning™ HYPERStack™ Zellkulturgefäße: Multiply Your Cells, Not Your Work. Corning Inc. 2023. www.corning.com/emea/en/products/life-sciences/products/bioprocess/hyper-platforms/hyperstack-platform.html.