Timing ist alles: Wann sollte man cGMP in Betracht ziehen?
Die aktuelle gute Herstellungspraxis "Current Good Manufacturing Practice" (cGMP) ist von zentraler Bedeutung für die Arzneimittelherstellung, da sie dazu beiträgt, Chemikalien und andere Rohstoffe unter Einhaltung bestimmter Kontrollen und Qualitätssysteme zu produzieren. Trotz des bedeutenden Einflusses von cGMP auf die Qualität und Konsistenz von Arzneimitteln zeigt eine kürzlich durchgeführte Studie1, dass nur etwa die Hälfte der Entwickler von Biopharmazeutika cGMP-Chemikalien in der frühen Phase der klinischen Prüfung verwenden.
Angesichts der raschen Entwicklung komplexer Biologika und des ständigen Drucks, die Produktion voranzutreiben, können die Folgen der Einführung eines nicht konformen Rohstoffs katastrophal sein.
Häufig werden in der Anfangsphase Rohstoffe verwendet, die nur für Forschungszwecke verwendet werden (RUO-Rohstoffe). RUO-Rohstoffe unterliegen nicht den gleichen strengen Herstellungs- und Qualitätskontrollen wie cGMP-Rohstoffe. Aus diesem Grund können Variablen, die versehentlich durch die Verwendung von RUO-Chemikalien eingeführt werden, zu Nacharbeiten und möglicherweise zur Zurückweisung ganzer Chargen des fertigen Arzneimittels führen.
Durch die Verwendung von cGMP-Rohstoffen zu einem früheren Zeitpunkt im Arzneimittelentwicklungsprozess können die Hersteller diese Risiken jedoch minimieren und ihre Entwicklungsmeilensteine beschleunigen.
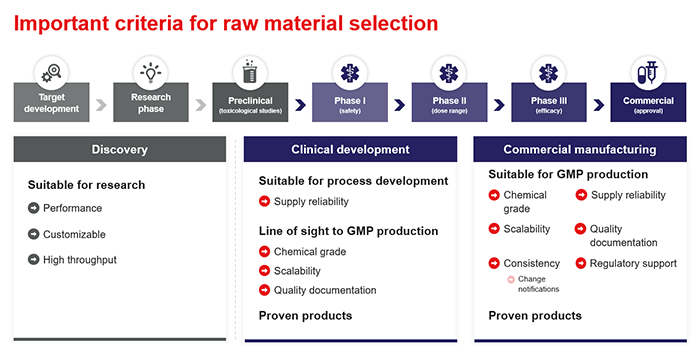
Ein reibungsloser Übergang
Chemikalien, die nach den strengen cGMP-Standards hergestellt werden, lassen eine hohe Qualität erwarten. Sie werden mit einer umfassenden Zertifizierung verkauft, die die Konformität jeder hergestellten Charge mit den veröffentlichten Normen dokumentiert. Der Internationale Harmonisierungsrat (ICH) und viele andere Regulierungsbehörden schreiben im Allgemeinen vor, dass nach cGMP hergestellte Materialien und Lieferanten erst nach Abschluss der präklinischen Versuche eingeführt werden.
Eine frühere Einführung von cGMP-Chemikalien kann jedoch dazu beitragen, dass der Übergang von der Forschungsphase zur klinischen Produktion nahtlos erfolgt. Auf diese Weise werden die realen Bedingungen, unter denen das Medikament in der ersten klinischen Prüfung am Menschen eingesetzt wird, besser simuliert. Andererseits erfordert ein Wechsel der chemischen Sorte, der Spezifikation oder des Lieferanten beim Übergang zu FIH-Versuchen eine zusätzliche Validierung und Qualifizierung, die zeit- und ressourcenintensiv ist. Eine frühzeitige Planung dieser Konformitäts- und Qualitätsstandards kann erheblich dazu beitragen, Kosten und Komplexität zu minimieren.
Erwarten Sie das Unerwartete
Der Wettbewerb um lebenswichtige Rohstoffe hat ein noch nie dagewesenes Ausmaß erreicht. Obwohl die Störungen, die durch Nachfragespitzen entstehen, diese Probleme sicherlich noch verschärfen können, sind Engpässe schon seit geraumer Zeit eine Herausforderung. Die Bewertung der Verfügbarkeit und der Qualität Ihrer Chemikalien, auch für RUO, und der Aufbau von Beziehungen zu vertrauenswürdigen Lieferanten können einen großen Beitrag zur Abmilderung möglicher Versorgungsunterbrechungen leisten.
Sobald Ihre Daten den Übergang zu klinischen Versuchen unterstützen, lohnt es sich, bei Ihren Lieferanten nach höherwertigen Chemikalien zu suchen. Diese "Vorarbeit" kann Ihnen den Weg in späteren Phasen erleichtern, da die Notwendigkeit, schnell zu handeln, bedeutet, dass Sie sich Zeit nehmen müssen, um Materialien zu organisieren und Prozesse zu dokumentieren sowie den Übergang zu planen. Ein besserer Input führt zu einem besseren Output.
Planen Sie den Erfolg
Ein Qualitätslieferant wird Ihnen helfen, Risiken zu verringern sowie Verschwendung und Ineffizienz bei der Lieferung Ihrer Chemikalien zu vermeiden. Wenn Sie cGMP früher in Ihre Arbeitsabläufe einbeziehen, können sich Ihre Teams auf das konzentrieren, was sie am besten können: die Entwicklung neuer, potenziell lebensrettender Medikamente. Ein solcher Lieferant verfügt über ein engagiertes Team mit Erfahrung in der cGMP-Chemikalienversorgung, das Sie von den frühen klinischen Phasen bis hin zur Vermarktung unterstützt und in der Lage ist, Ihre Lieferkette transparent zu gestalten und Ihre Produktionsplanung transparent zu machen.
Thermo Fisher Scientific™ bietet cGMP-Distribution und Erfahrung in der Lieferkette, um Kunden zu helfen, ein Kopfzerbrechen beim Scale-up zu vermeiden. Durch unsere globalen Beziehungen zu Herstellern und Lieferanten rationalisieren unsere Dienstleistungen nicht nur die Vorproduktionsprozesse, sondern sorgen auch dafür, dass die Produktion in Übereinstimmung mit den Qualitäts- und Regulierungsstandards abläuft, so dass Sie jeden Schritt Ihres Biomanufacturing-Workflows mit ruhigem Gewissen angehen können.
Referenzen
1 Entnommen aus Berichten und Studien von Thermo Scientific Production Chemicals and Services, https://www.thermofisher.com/us/en/home/life-science/bioproduction/production-chemicals-services.html

