Ersatzorgane aus der Kulturschale
Von Dr. Hue-Tran Hornig-Do.
Was sind Miniorgane und wie entstehen sie?
Klingt die Herstellung von Miniaturversionen von Organen in einer Schale nach Science-Fiction? Dank der Fortschritte in der Stammzelltechnologie und im Bioengineering sind WissenschaftlerInnen heute in der Lage, Organoide mit ähnlichen Eigenschaften wie Organe künstlich zu züchten. Das war meine Erfahrung, als ich zum ersten Mal in meinem Leben ein Miniorgan sah: Ich war erstaunt und schockiert zugleich, als ich den Zellklumpen unter dem Mikroskop betrachtete, der wie ein echtes Herz schlug. Er pulsierte und das in einem hypnotisierenden Rhythmus. Unglaublich! „Was ist das?“, fragte ich aufgeregt meine Kollegin, die mir gerade den neuesten Erfolg ihrer Studie präsentierte. „Das sind menschliche Miniherzen, an denen ich seit drei Monaten arbeite.“, sagte meine Kollegin, eine Stammzellbiologin, die davon träumt, Herzversagen mit Hilfe von Stammzellen zu heilen.
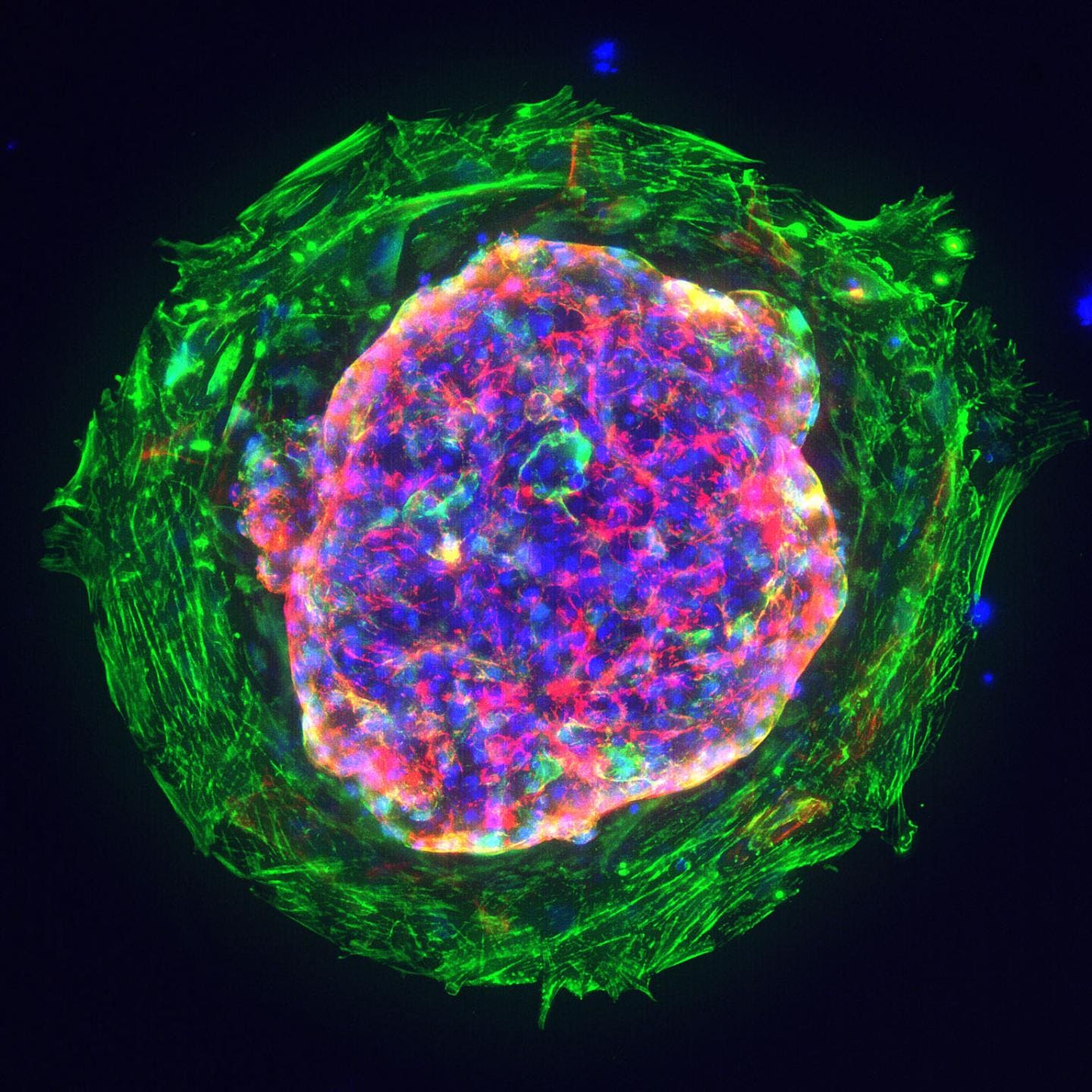
Abbildung 1: Aus menschlichen iPS-Zellen erzeugte Herzmikrokammer; Kardiomyozyten (rot), Myofibroblasten (grün), Zellkerne (blau); Quelle: Zhen Ma, University of California, Berkeley.
Mit einem Durchmesser von etwa 1 bis 2 Millimetern waren die Miniherzen, die auch als Herz-Organoide bezeichnet werden, unter dem Mikroskop nicht größer als Sesamkörner. Sie enthielten die wichtigsten Zelltypen, die in diesem Entwicklungsstadium typischerweise vorhanden sind, und wiesen eine klar definierte Herzkammer auf, die mit 60 bis 100 Schlägen pro Minute schlug, was der Herzfrequenz eines Embryos im selben Alter entspricht. Organoide sind eine dreidimensionale Anordnung von Zellen, welche die Struktur, Funktion, Genspezifität und andere Merkmale des Ausgangsgewebes nachahmen.1 Sie werden aus Stammzellen gewonnen, welche die Fähigkeit haben, sich zu verschiedenen Zelltypen im Körper zu entwickeln.
Um Stammzellen zu erhalten, isolierte meine Kollegin Hautzellen von verschiedenen Spendern und programmierte sie in vielseitige Stammzellen um, so genannte iPSCs (induzierte pluripotente Stammzellen).2 Die iPSCs wurden dann durch Zugabe verschiedener essentieller Wachstumsfaktoren, Signalstoffe und Matrizen zu Kardiomyozyten und anderen Zellen differenziert, aus denen ein menschliches Herz heranreifen kann.3 „Es war wie ein Wunder: Die Stammzellen organisierten sich zu einer dreidimensionalen Struktur, die dem Herzen ähnelte. Einfach so. Aber meine Miniherzen können kein Blut pumpen, noch nicht.“, kommentierte meine Kollegin mit einem Lächeln. Seitdem hat sich die Stammzellforschung rasant weiterentwickelt, und ForscherInnen konnten Organoide herstellen, die dem Gehirn, der Niere, der Lunge, dem Darm, der Netzhaut, dem Magen und vielen anderen Organen sehr ähnlich sind.1
Was lernen wir aus der Züchtung von Organoiden?
Durch die Herstellung von Organoiden aus patienteneigenen Stammzellen können WissenschaftlerInnen untersuchen, wie sich Organe bilden und wachsen, und so neue Erkenntnisse über die menschliche Entwicklung und Krankheitsmechanismen gewinnen. Mit Organoiden können die komplexen Anordnungen und Interaktionen von Zellen im dreidimensionalen Raum untersucht werden, was mit den meisten anderen Versuchsmodellen nicht möglich ist.
Die Miniorgane haben sich als neue, vielversprechende Modelle für die Entdeckung und Entwicklung von Arzneimitteln erwiesen, bei denen zahlreiche Wirkstoffe an Zellen getestet werden müssen, um zu sehen, wie sie wirken. Bisher hat sich die Pharmaindustrie für solche Tests auf Tiermodelle und menschliche Zelllinien verlassen, die wenig Ähnlichkeit mit normalem oder krankem Gewebe haben. Durch die Verwendung von Organoiden können wir lernen, wie die Organe eines Menschen auf verschiedene Medikamente oder Behandlungen reagieren. Dies könnte zu gezielteren und wirksameren Therapien führen, die auf die individuellen Bedürfnisse der einzelnen Patienten zugeschnitten sind. Schließlich trägt die Verwendung von Organoiden dazu bei, ethische Probleme abzumildern – z. B. indem Tierversuche ersetzt werden können.
Können wir Organoide verwenden, um Gewebe für Transplantation zu züchten?
Die regenerative Medizin sieht sich seit einiger Zeit mit Problemen wie dem Mangel an Spendern, der Abstoßung durch das Immunsystem und ethischen Fragen konfrontiert, welche die Suche nach Alternativen immer wichtiger machen.
"Die Verwendung von Stammzellen zur Reparatur oder zum Ersatz von beschädigten oder kranken Geweben und Organen ist eine vielversprechende Alternative."
Organoide können schnell in vitro hergestellt werden und behalten die 3D-Struktur, Funktion, Genetik und phänotypische Spezifität des ursprünglichen Gewebes bei. Diese Vorteile sind entscheidend für transplantierbare, immune und funktionelle Gewebe oder Organe, was zweifellos eine neue Ära für die regenerative Medizin einläutet. Tatsächlich wurden Organoide für Darm4, Leber5, Niere6 und Bauchspeicheldrüse7,8 der Maus erfolgreich bei Mäusen transplantiert, wobei die Organfunktion unter experimentellen Bedingungen wiederhergestellt wurde. Darüber hinaus wurde in Japan bereits mit einer Studie zur Transplantation von IPSC-Hornhautzellen begonnen.9 Bis Organoide in Zukunft als körpereigene Ersatzorgane dienen können, ist es jedoch noch ein weiter Weg.
Was sind die Herausforderungen, die vor der klinischen Anwendung zu bewältigen sind?
Organoide sind noch zu klein, und es besteht noch eine Diskrepanz zwischen ihren Funktionen und denen von normalem Gewebe. Wenn Organoide eine gewisse Größe erreichen, können die Zellen im Zentrum nicht mehr ausreichend mit Nährstoffen versorgt werden, und die Beseitigung von Stoffwechselabfällen in den Zellen ist schwierig, da den meisten Organoiden Gefäßzellen fehlen. Die vaskuläre Organisation zukünftiger Organoide stellt in der Tat eine große Herausforderung dar. In ähnlicher Weise ist es notwendig, ein angemessenes Innervationssystem in den Organoiden der Zukunft zu schaffen. WissenschaftlerInnen entwickeln derzeit verschiedene Methoden, um andere Zellsysteme, wie z. B. das Gefäßsystem, in Organoide zu integrieren. Zusammenfassend lässt sich sagen, dass Organoide den ForscherInnen zwar zahlreiche Vorteile und Möglichkeiten bieten, dass sie aber auch Grenzen haben und andere Versuchssysteme noch nicht vollständig ersetzen können.
Ganz gleich, ob Sie in der Stammzellforschung tätig sind, Organoide züchten, eine Stammzelltherapie entwickeln oder neue Medikamente mit Stammzellen testen: Wir bieten ein komplettes Portfolio an Produkten und Werkzeugen für die Stammzellforschung von führenden Herstellern an, die Ihre Arbeitsabläufe vereinfachen und die Kontinuität, Effizienz und Präzision ermöglichen, die Ihre Forschung vorantreiben. Erfahren Sie jetzt mehr über Stammzellen.
Referenzen
1. Clevers H. Modeling development and disease with organoids. Cell. (2016) 165:1586–97.
2. Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. (2007) 131:861–72.
3. Cyganek L, Tiburcy M, Sekeres K, Gerstenberg K, Bohnenberger H, Lenz C, et al. Deep phenotyping of human induced pluripotent stem cell-derived atrial and ventricular cardiomyocytes. JCI Insight. (2018) 3:e99941
4. Yui, S. et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5+ stem cell. Nat. Med. (2012) 18:618–623.
5. Huch, M. et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. (2013) 494:247–250.
6. Toyohara T, Mae S, Sueta S, Inoue T, Yamagishi Y, Kawamoto T, et al. Cell therapy using human induced pluripotent stem cell-derived renal progenitors ameliorates acute kidney injury in mice. Stem Cells Transl Med. (2015) 4:980–92.
7. Georgakopoulos, N. et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Dev. Biol. (2020) 20: 4.
8. Yoshihara E, O'Connor C, Gasser E, Wei Z, Oh TG, Tseng TW, et al. Immune-evasive human islet-like organoids ameliorate diabetes. Nature. (2020) 586:606–11.
9. Hayashi R, Ishikawa Y, Sasamoto Y, Katori R, Nomura N, Ichikawa T, et al. Co-ordinated ocular development from human iPS cells and recovery of corneal function. Nature. (2016) 531:376-80.