Scale-out und Scale-up: Wie man Zelltherapien im großen Maßstab ermöglicht
Von Dr. Hue-Tran Hornig-Do.
Der Bereich der Zelltherapien entwickelt sich schnell weiter, und die Deckung der wachsenden Nachfrage stellt Hersteller vor erhebliche Herausforderungen. Eine effiziente Produktion ist ein wichtiger Faktor für die Entscheidung, ob eine Zelltherapie kommerzialisiert werden soll. Die Herstellung einer großen Anzahl von Medizinprodukten auf der Basis lebender Zellen ist jedoch nicht ohne Herausforderungen. Da die Zellen das therapeutische Produkt sind, müssen sie ihren Phänotyp und ihre Funktionalität unabhängig vom Herstellungsverfahren in allen Phasen des Prozesses bewahren.
Scale-out oder Scale-up
Zur Erzeugung größerer Anzahlen von Zellen gibt es zwei gängige Strategien: das Scale-up und das Scale-out. Scale-up-Systeme basieren auf dem Einsatz größerer Gefäße, um die Produktionskapazität zu steigern, während Scale-out-Systeme mehrere Kulturgefäße parallel nutzen.1,2 Beide Strategien haben ihre Vor- und Nachteile und schließen sich nicht unbedingt gegenseitig aus. Umfassende Arbeitsabläufe beinhalten oft beide Strategien. Das Scale-out ist relativ unkompliziert, da die Produktionseinheit unverändert bleibt. Allerdings kann die Reproduzierbarkeit schwierig zu erreichen sein. Das Scale-up hingegen ist komplexer und erfordert mehr Planung, kann aber die Kosten des Produkts langfristig senken. Welche Strategie Sie anwenden sollten, hängt davon ab, wie viel Material für das herzustellende Therapeutikum benötigt wird. Lassen Sie uns diese Frage am Beispiel der autologen und allogenen Zelltherapie näher betrachten.
Autologe Zelltherapien sind Beispiele für personalisierte Medizin, bei denen patienteneigene Zellen als Ausgangspunkt dienen und die in einer einzigen Charge pro Patient hergestellt werden.3 Hier kann das Konzept des Scale-out angewendet werden, bei dem mehrere parallele Produktionslinien für individuelle Patientenprodukte eingerichtet und in derselben Produktionsstätte gleichzeitig betrieben werden. Ein solcher Scale-out-Herstellungsansatz kann auch auf andere Produktionsanlagen übertragen werden, um die Produktion zu steigern. Dieses Modell wird zum Beispiel derzeit von Biotechnologie-Unternehmen, die sich mit der Herstellung von chimärischen Antigenrezeptor (CAR)-T-Zellen befassen, durch die Einrichtung regionaler Produktionsstätten in den Vereinigten Staaten und Europa sowie die Expansion in weitere Regionen angewendet. Allogene Therapien hingegen werden in großen Mengen aus Gewebe nichtverwandter Spender hergestellt und gelten als „Serienprodukte“, die zur Behandlung zahlreicher Patienten verwendet werden.4 Für diese Therapien ist ein Scale-up erforderlich, das durch Vergrößerung des Volumens der Produktionsgefäße erreicht wird.
Adhäsions- oder Suspensionsplattform
Welche Scale-up-Methode ist für meinen Ansatz am besten geeignet? Ob Sie eine Suspensions- oder Adhäsionsplattform verwenden sollten, hängt im Grunde vom Zelltyp ab. Zellkulturplattformen versuchen im Wesentlichen, die native Umgebung für die zu züchtende Zelle nachzuahmen. So eignen sich zum Beispiel Zellen aus festem Gewebe wie Muskeln besser für Adhäsionskulturen, während Zellen aus flüssigem Gewebe wie Blut besser für Suspensionskulturen geeignet sind. CAR-T-Zellen sind nichtadhärent und können in Suspensionssystemen kultiviert werden, während Stammzellen meistens in kontaktabhängigen Nischen existieren, wo sie in direktem Kontakt mit anderen Zellen und extrazellulären Matrizen stehen, erfolgreich mit adhärenten Plattformen expandiert werden können.
Ein wichtiger Vorteil von Adhäsionsplattformen ist die Möglichkeit, verschiedene Oberflächenmodifikationen anzuwenden, die eine lokale Mikroumgebung nachahmen. In einigen Fällen bieten adhärente Systeme auch eine direkte Visualisierung, z. B. kann das Zellwachstum in Flaschen oder gestapelten Gefäßen leicht unter dem Mikroskop beobachtet werden. Adhärente Kulturen sind auch ein Geschenk der Zeit, ein großer Vorteil für Start-ups, die schnell auf den Markt kommen wollen. Diese und weitere Vorteile machen adhärente Zellkultursysteme zu einer guten Wahl für zahlreiche Zell- und Gentherapieprogramme, die häufig verankerungsabhängige Zelltypen beinhalten.
Das Scale-up in einer Suspensionsplattform gilt jedoch seit langem als die bevorzugte Methode. Ein Grund dafür ist, dass Suspensionskulturen in konventionellen, großen Rührkessel-Bioreaktoren gezüchtet werden können, was die Anzahl der Verarbeitungsschritte reduziert und den Platzbedarf der Anlagen minimiert. Allerdings birgt das Scale-up von Zellen in Suspensionskulturen in größeren Gefäße auch einige Tücken. Sorgfältiges Rühren ist erforderlich, um einen angemessenen Gas- und Nährstoffaustausch zu gewährleisten und gleichzeitig die durch Scherkräfte verursachten Zellschäden zu minimieren.5 Eine gründliche Evaluierung der Flussdynamik in der Kultur auf der Grundlage von Gerätespezifikationen (z. B. Anzahl der Propeller, Rührgeschwindigkeiten und Mischstrategien) ist unumgänglich, um potenzielle Auswirkungen auf die Zellen zu bestimmen. Trotz dieser Herausforderungen bieten Suspensionskulturen Skalierbarkeit und können die für Anwendungen benötigten großen Zellmengen produzieren. Diese Skalierbarkeit und Kontrolle machen Suspensionsplattformen zu einer attraktiven Option für Hersteller, die ihre betriebliche Effizienz steigern wollen.
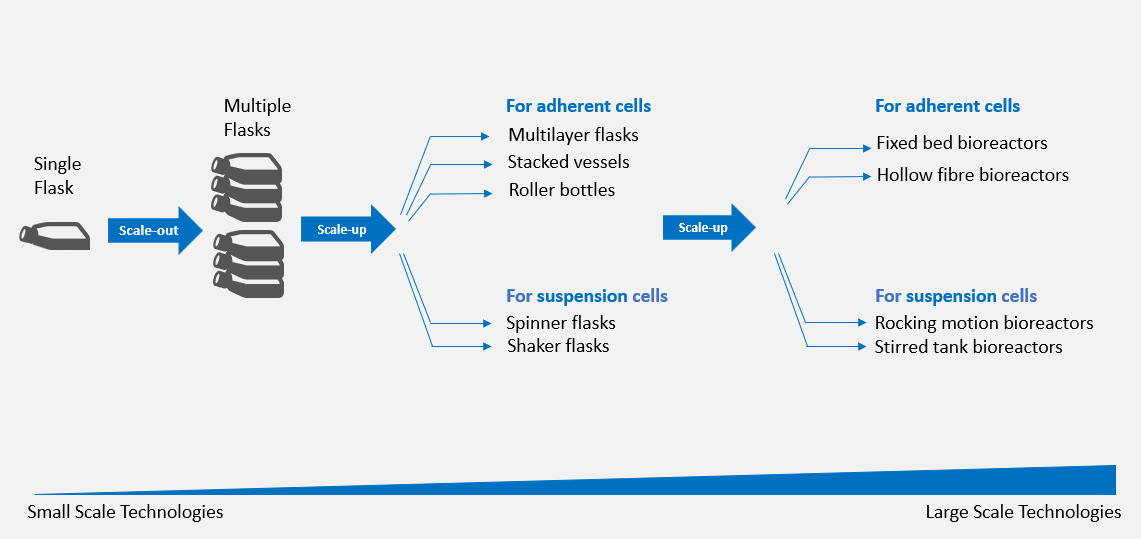
Abbildung 1: Systeme zur Skalierung von adhärenten und suspendierten Zellkulturen
Ist es möglich, adhärente Zellen dazu zu bringen, die Modalitäten zu ändern und sie für die Bedingungen der Suspensionskultur anzupassen? Die Antwort lautet ja, und ein klassisches Beispiel ist die Herstellung monoklonaler Antikörper mit Ovarialzellen des chinesischen Hamsters (CHO). Die Forscher haben diese Kulturen so modifiziert, dass sie in einer Suspensionsumgebung gedeihen - und heute werden monoklonale Antikörper hauptsächlich auf diese Weise hergestellt. Dies erfordert jedoch oft eine umfangreiche Anpassung und manchmal auch eine genetische Veränderung von adhärenten Zelllinien, um sie für Suspensionskulturbedingungen geeignet zu machen. Dies erfordert zusätzliche Zeit und Arbeit.
Die Frage ist, ob sich der enorme Aufwand für Ihren Bedarf lohnt. Nicht jedes Therapeutikum muss in einem solchen Maßstab produziert werden. Für autologe Therapien und Gentherapien, die auf seltene Erkrankungen oder kleine Patientenpopulationen abzielen, reicht möglicherweise die Produktion in einem kleineren Maßstab aus. Zusätzlich wurden bei der Entwicklung adhärenter Zellkulturplattformen große Fortschritte erzielt. Diese haben zur Einführung neuer Technologien wie Mikrosphären und Festbett-Bioreaktoren geführt, die es ermöglichen, mit Adhäsionskulturen ähnliche Maßstabseffekte wie mit Suspensionsmethoden zu erzielen. Sehen wir uns verschiedene Zellkultursysteme an.
Kultursysteme vom kleinen bis zum industriellen Maßstab
Zellen, die in kleinen Kultursystemen, z. B. in einem einzelnen T-Flaschen, kultiviert werden, können in mehrere Flaschen erweitert werden. In der Labormaßstabsphase kann zum Scale-up eines Prozesses eine Übertragung in größere Gefäße erfolgen. Mehrschichtige Flaschen, gestapelte Gefäße und Rollflaschen werden am häufigsten für das Scale-up von adhärenten Kulturen verwendet, während Spinnerflaschen und Schüttelkolben eine gute Wahl für das Scale-up von Suspensionszellen sind (Abb. 1).
Bei Bedarf kann der Prozess dann in den industriellen Maßstab überführt werden. Wave-Bioreaktoren, Rührkessel-Bioreaktoren, Festbett-Bioreaktoren und Hohlfaser-Bioreaktoren gehören zu den vier fürs Scale-up im industriellen Maßstab am häufigsten verwendeten Geräten. Wave- und Rührkessel-Bioreaktoren kommen weitflächig für die Expansion von Suspensionszellen wie T-Zellen6 zum Einsatz, während die Bioreaktoren mit einem strukturierten Träger wie Festbett- und Hohlfaser-Bioreaktoren zur Expansion von adhärenten Zellen wie MSCs und aus der menschlichen Nabelschnur gewonnenen HSCs verwendet wurden7,8.
Ist es möglich, adhärente Zellen in einem Suspensionssystem zu züchten? Mikrosphären sind kleine Kugeln, die in verschiedenen Größen und Materialien sowie mit unterschiedlichen Beschichtungen erhältlich sind, die das Wachstum von adhärenten Zellen in einem Suspensionssystem ermöglichen. Sie können vornehmlich zur Durchführung von Vorabtests in Spinnerflaschen abgefüllt werden, bevor sie in größere Rührkessel-Bioreaktoren übertragen werden, um ein hybrides Adhäsions-/Suspensionssystem zu erzeugen9.
Fazit: Es gibt keine Universalplattform. Die verschiedenen Technologien bieten jeweils spezifische Vorteile, die abhängig von Ihren Ressourcen und Ihrem Maßstab sowie Ihrem Visualisierungs- und Automatisierungsbedarf für Sie von unterschiedlichem Gewicht sind. Letztendlich geht es darum, herauszufinden, was Ihre Bedürfnisse sind und was Sie von Ihrer Plattform erwarten.
Wir von Fisher Scientific helfen Ihnen dabei, herauszufinden, welche Lösung Ihre Ziele am besten unterstützen kann. Unser Ziel ist es, Forscher und Hersteller bei der Weiterentwicklung innovativer Zelltherapien zu unterstützen, indem wir zuverlässige Produkte und Werkzeuge bereitstellen, darunter eine breite Palette innovativer Kultursysteme von führenden Herstellern.
Referenzen
1. Roh K-H, Nerem RM, Roy K. Biomanufacturing of therapeutic cells: state of the art, current challenges, and future perspectives. Ann Rev Chem Biomol Eng. (2016) 7:455–78.
2. Macdonald GJ. Scale-out plus single-use can multiply yields: single-use technology reduces some biomanufacturing equations to scale-out> scale-up. Genetic Eng Biotechnol News. (2019) 39:46–8.
3. Fesnak AD. The challenge of variability in chimeric antigen receptor T cell manufacturing. Regen Eng Transl Med. (2020) 6:322–9.
4. Caldwell KJ, Gottschalk S, Talleur AC. Allogeneic CAR Cell Therapy—More Than a Pipe Dream. Front. Immunol. (2021) 11:618427.
5. Eaker S, Abraham E, Allickson J, Brieva TA, Baksh D, Heathman TRJ et al. Bioreactors for cell therapies: current status and future advances. Cytotherapy (2017) 19:9–18.
6. Smith TA. CAR-T cell expansion in a Xuri cell expansion system W25. Methods Mol Biol (2020) 2086:151–63. 7. Park S, Stephanopoulos G. Packed bed bioreactor with porous ceramic beads for animal cell culture. Biotechnol Bioeng. (1993) 41:25–34.
8. Gagliardi C, Khalil M, Foster AE. Streamlined production of genetically modified T cells with activation, transduction and expansion in closed-system G-Rex bioreactors. Cytotherapy (2019) 21:1246–57.
9. Bodiou V, Moutsatsou P, Post MJ. Microcarriers for upscaling cultured meat production. Front Nutr. (2020) 7:10.




22_04.jpg-650.jpg)